#든든한 식약
12월의 든든한 식의약 소식

2015년 3월 의약품 허가-특허연계 제도가 전면 시행되어 후발의약품 판매금지, 우선판매품목허가 등 의약품 시장경쟁에 직접 영향을 미치는 제도의 도입 시행 되었다.
의약품과 관련해선 연구개발에 막대한 시간과 비용이 소모되기 때문에 특허를 통해 권리를 보호하고 새로운 의약품 개발 의욕을 촉진하고 있다.
한편, 후발의약품은 특허 이후 또는 특허를 피해 시장에 진입하여 경쟁을 형성함으로 사회의 보건의료비를 절감에 기여한다.
최근 의약품 분야의 발전이 두드러지면서 의약품관련 많은 특허 소송이 일어나고 있다.

이로 인해 의약품 개발·출시 과정에서의 특허문제 해결 및 특허분쟁에 대한 중요성이 크게 대두되었다.
최근 해외 특허 판례를 중심으로 의약품 특허와 판례를 구체적으로 살펴보자.
모더나 코로나 백신관련 특허 소송

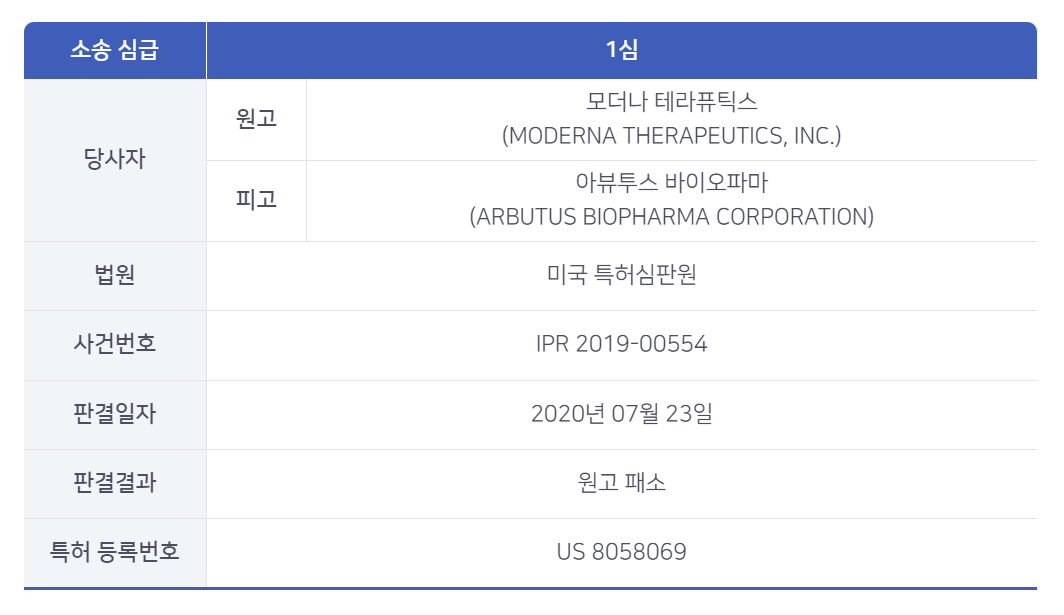
이 재판은 모더나의 코로나 mRNA 백신과도 연관이 있다.
특허관련 문제가 된 기술은 LNP(Lipid nanoparticle) 기술로서, 생체 내에서 불안정한 mRNA 약물 등을 세포 안에 안정적으로 투입하는 기술이기에 현재도 많은 연구가 수행되고 있다.
피고인 아뷰투스 바이오파마는 이 LNP 기술과 관련하여 안정한 핵산-지질 입자(Stable Nucleic Acid-Lipid Particle; SNALP) 및
그것의 제조방법, 그리고 그것을 타겟세포에 전달해서 단백질을 발현하는 방법에 관한 특허를 보유하고 있다.
원고인 모더나는 사전에 아뷰투스 바이오파마의 LNP에 대하여 제한된 라이센스를 가지고 있었으나,
2018년 이후 특허무효심판을 제기, 본 건보다 앞서 진행된 2건에 대하여는 아뷰투스 바이오파마에 대하여 승소 혹은 일부승소하였다.
본 건에 대하여도 원고인 모더나는 피고인 아뷰투스 바이오파마의 특허가 제시하고 있는 인지질의 함유량 범위(입자 내 총 지질의 4~10 mol%)가 과거에 발표된 문헌들로부터
쉽게 유추 가능하기 때문에 무효가 되어야 한다고 주장하였다.
[그림] 모더나는 본 LNP 기술이 코로나 백신에 적용되었는지 명확히 밝히고 있지 않으나, 적용되었을 것으로 보고 있다(특허청 mRNA 백신 특허분석 보고서)(사진출처 : 약학정보원)
하지만, 이에 대해 미국 특허심판원은 원고의 청구를 기각하였다. 즉, 특허가 유효라고 판단한 것이다.
왜?

재판부는 판결문에서 청구된 조성물의 범위가 종래 기술에 개시된 범위와 겹치고 이러한 중첩범위로 자명성을 추정하지만 몇몇 예외적인 상황에선 중복 범위에 기반한 자명성이 반박될 수 있음을 인정하였다.
그 중 한 이유는 중첩 범위로부터 도출된 결과가 종래 기술의 결과와 정도가 다르거나 예상치 못한 새로운 결과가 도출되는 경우로서, 이 경우가 여기에 해당한다고 판단한 것이다.
그 중 한 이유는 중첩 범위로부터 도출된 결과가 종래 기술의 결과와 정도가 다르거나 예상치 못한 새로운 결과가 도출되는 경우로서, 이 경우가 여기에 해당한다고 판단한 것이다.
즉, 조성물의 범위 자체는 종래 기술에 제시되어 있다고 하더라도 그것으로부터 도출된 결과가 예상을 훨씬 상회하는 경우엔 특허성이 인정된단 뜻이다.
다만 이를 입증하지 못하면 특허는 특허성을 잃어버리게 된다.
일례로, UCB는 악타비스와의 재판에서 특허성을 입증하는데 실패하여 로티고틴에 대한 특허 US 10130589에 대해 델라웨어 지방법원에서 무효 판결을 받았다.
비슷한 판례는 일본에서도 관찰된다.
의약품 분야에서 통상의 지식을 가진 사람이 어떤 의약품의 구성을 생각해내는 것은 어렵지 않으나 그것이 예측을 상회하는 현저한 효과를 만들어 낼 수 있을 때 특허는 무효가
아니라고 판시한 것이다(令和 2年(行ケ)第10004号 참조).
이는 의약품 산업의 특수성에 기인한다.
의약분야의 발명은 실제로 실시해야지만 효과의 정도를 알 수 있기 때문에 통상의 기술자가 출원 당시 해당 발명의 구성을 쉽게 예측할 수 있다 하더라도 실제 효과의 정도를 예상할 수 없는 경우가 많다.
따라서 효과에 대해서 명확히 주장해야 할 필요가 있고 그것이 특허명세서에 제대로 표현이 되어야 하는 것이다.
뇌전증 치료제관련 특허 소송


원고UCB Inc.는 뇌전증 치료제인 라코사미드 관련 특허
US RE38551의 특허권자로서, 이 성분을 유효성분으로 하는 다양한 제형의 의약품(Vimpat®)에 대한 FDA 승인을 보유하고 있다.
한편, 위탁 제약사인 피고카탈렌트 파마솔류션이 고객 A사의 개량신약에 의한 의약품 허가 신청에 따른 제조 및 시험 서비스를
시행하기 위해 487.5kg의 라코사미드를 켄터키주의 윈체스터 소재 시설로 수입함에 따라, 원고는 피고를 상대로 이 라코사미드를 미국 내에서 제조, 사용, 판매 및 이를 포함하는 제품의 수입을
금지 명령하는 예비 가처분 신청을 제기하였다.
[그림] 뇌전증 치료제로 쓰이는 Vimpat은 2018년 한국 시장에서 철수하였다(사진출처 : 분당서울대병원)
일반적으로는 특허로 보호받는 성분을 이용한 발명의 제조, 사용 및 판매는 특허의 침해이나, 재판부는 특허침해가 없다고 판단하여 원고의 가처분 신청을 기각하였다.
왜?
미국의 허가특허연계제도는 예외적으로 의약품의 FDA허가를 위한 자료 획득 실험은 특허 침해가 되지 않는다고 명시하였기 때문이다.
이는 제네릭 의약품이 조기에 출시될 수 있도록 하기 위한 제도적인 장치라고 할 수 있다.
우리나라도 특허법에 약사법에 따른 의약품의 품목허가·품목신고를 위한 연구 또는 시험은 특허권의 효력이 미치지 않는다고 명시하고 있다.
큐어백의 mRNA의 의학적 사용에 관한 소송

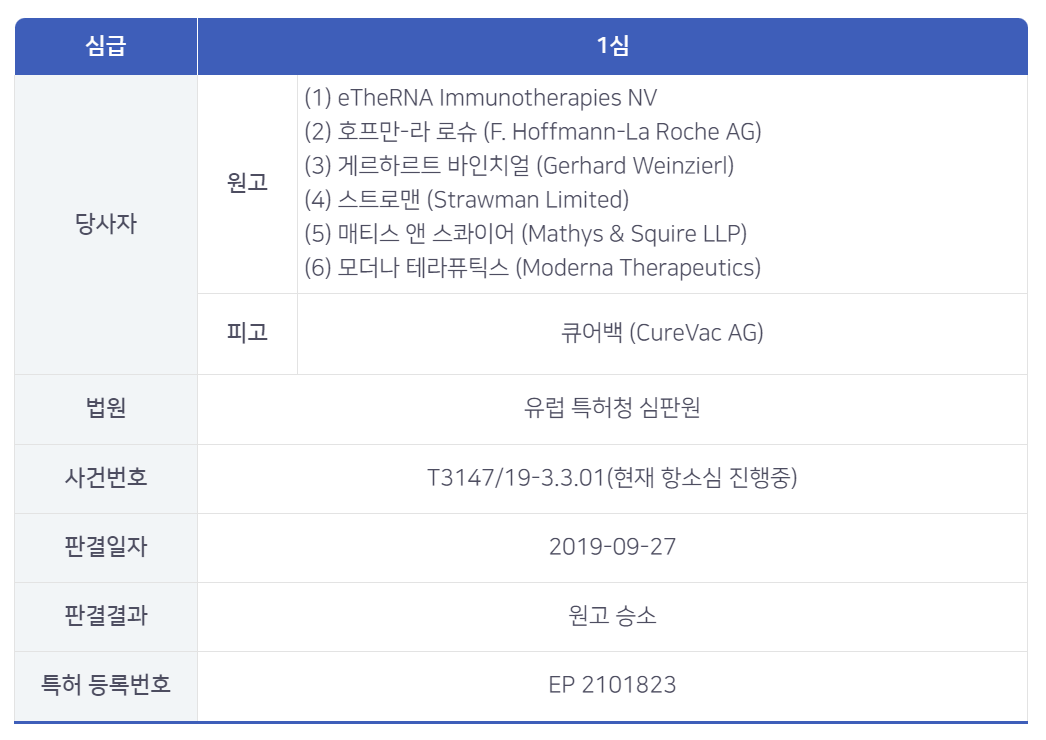
문제가 된 특허는 mRNA의 의학적 사용에 관한 것으로서, 두 가지 실시예를 공개하였다.
다만 제시된 두가지 예는 모두 예비적인 실시예였으며 실험관 내 (in vitro) 실험 자료로 제시된 것은 암 질환에서 발현된 종양 항원이나 변이된 항원을 식별하고 결합하는 mRNA 코딩된 항체에 관한 것이 전부였다.
하지만 본 특허는 광범위한 질병들의 생체 내 치료제로서의 사용까지 권리범위를 청구하고 있었다.
즉, 청구된 mRNA가 어떻게 그리고 어떤 조건하에 청구된 광범위한 질병의 치료제로서 적합한지에 대한 설명이 없고,실험관 내 (in vitro) 실시예를 근거로 생체 내 (in vivo) 기술의 범위까지 청구하고 있었던 것이다.
이러한 이유에 따라 원고는들은 피고가 이론상의 추측만으로 특허를 출원하여 이 연구 분야 전체를 독점하려 한다고 판단하여
유럽 특허청 심판원에 특허의 무효를 청구하였다.
한편, 피고특허권자는 이에 대응하기 위해 재판 과정 중에 보정된 청구 범위들을 제출하였다.
이에 재판부수정된 청구범위에 대하여 신규성 및 진보성이 인정되고 통상의 기술자가 해당 발명을 용이하게 실시할 수 있다고 판단하였다.
하지만, 유럽 특허청 심판원은 최종적으로 이 특허의 무효를 결정하였다.
특허는 기술을 모두에게 공개하는 것이니만큼 명세서를 명확하게, 그리고 통상의 지식을 가진 기술자가 과도한 실험적 부담 없이 재현하기에 충분하게 기재되어야 하는데, 재판부는 최종적으로 이를 해소하지 못한다고 판단
하였던 것이다. 이 특허의 명세서에선 naked mRNA를 종양이 있는 쥐의 꼬리 정맥을 통해 주입한 후 “종양의 성장을 모니터링 함” 이라고 기재했을 뿐, 예상 결과 수치를 공개하지 않아
실험 데이터가 불충분하였기에 이를 토대로 효과를 예측하기 어려웠을 것이라 판단했던 것이다.
[그림] COVID-19 팬데믹에서의 개발 성공 이후 mRNA 관련 연구개발은 더욱더 활발히 이루어질 것이다(사진출처 : Forbes)
기계장치에 관한 특허와는 달리 의약품 특허는 제시된 구성만으로 효과를 확실하게 알 수 없는 경우가 많기에 특허 출원 시에 실험 데이터를 제시할 필요가 있으나,
이 경우에는 그러한 실험 데이터가 명확하게 기재되어있지 않았기에 특허가 무효화 된 사례라고 할 수 있다.
이스라엘의 학자인 유발 하라리는 저서 ‘호모 데우스’에서 앞으로 생명공학이 인류의 미래를 크게 좌우할 것이라고 예언한 바 있다.
그의 말대로 현재 바이오 및 의약 분야에서 많은 발전이 이루어지고 있으며, 특히 K-제약바이오의 발전이 눈부시다.
한편, 한국의 제약산업이 세계로 뻗어나감에 따라 전세계 곳곳에서 관련 소송이 현재 진행 중이며, 이러한 소송은 앞으로도 점점 더 늘어날 것이라 생각된다.
이젠 국내뿐만 아니라 해외에서도 굳건히 버틸 수 있는 ‘강한 특허’를 만드는 것이 필요하다.
이를 위해 식약처는 의약품 해외 특허판례를 조사·분석하여 식약처 의약품안전나라 홈페이지에 공개하고 있으며 이를 통해 제약 바이오 기업의 연구 개발과 특허 전략 수립에 도움이
될 것으로 기대한다.